Preámbulo
LA TABLA PERIÓDICA Y EL CÓDIGO DA VINCI
Si quiere acción, pase directamente al capítulo 1. Si quiere una breve introducción a la tabla periódica, el pastoreo de los electrones y la idea de lo que Dan Brown podría hacer con ella, empiece aquí.
La tabla periódica de los elementos puede atemorizar a los estudiantes. Uno puede tener problemas con las conjugaciones de los verbos irregulares franceses, o puede tener tendencia a confundir el orden de los Eduardos, Ricardos y Enriques en la línea dinástica de los monarcas ingleses, pero los 114 elementos de la tabla periódica, sus símbolos y sus lugares en esta maraña de pequeñas cajas presentan otro tipo de complejidad.
Para los iniciados y los aficionados la tabla periódica es una fuente de fascinación inagotable, y aprenderla de memoria es el bautismo de fuego para los aspirantes a químicos. Para la gente corriente solo representa el paisaje químico en el que todos nos movemos, aunque las relaciones entre el mapa y nuestra realidad son a veces bastante vagas. Las historias contenidas en este libro tratarán de salvar esta distancia entre mapa y realidad mediante la narración de las aventuras, los éxitos y los fracasos de personas ordinarias y extraordinarias de todos los lugares del mundo en sus encuentros, intencionados o no, con diversos elementos químicos.
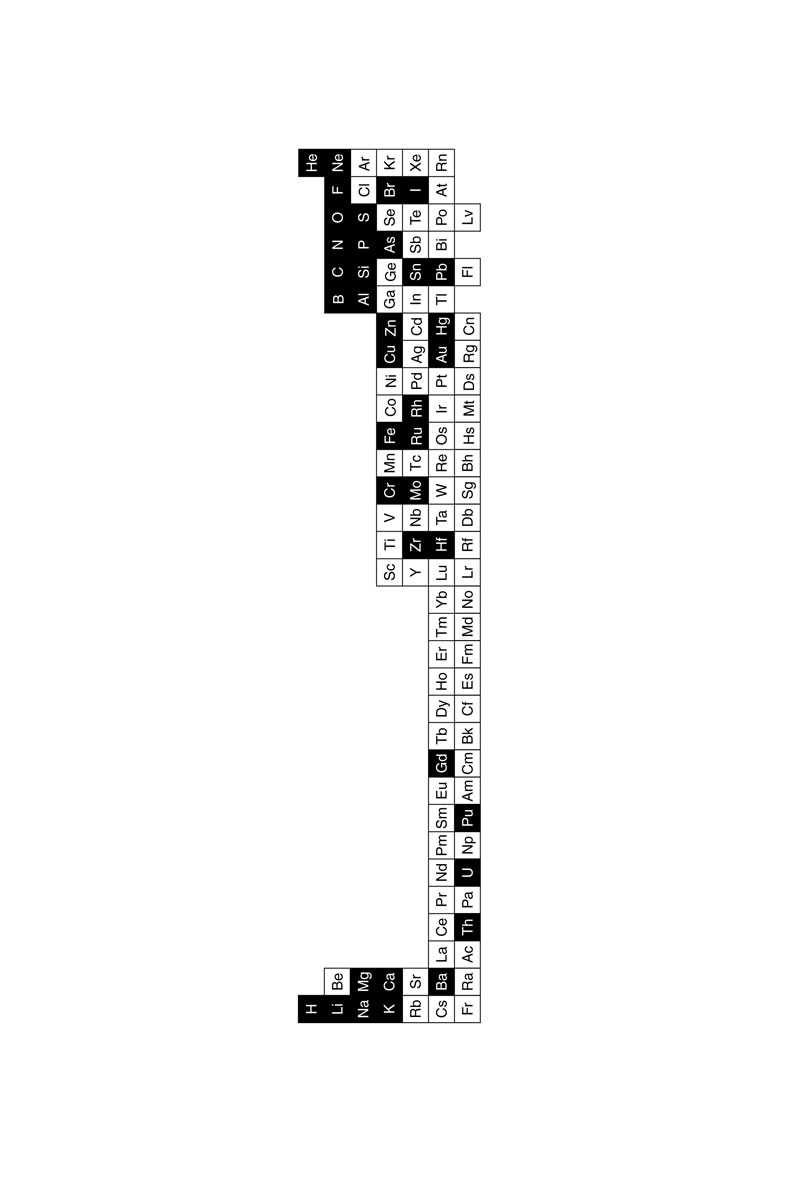
 F IGURA 1. La tabla periódica de 2012 según la Unión Internacional de Química Pura y Aplicada. Esta es la versión larga que tiene los elementos La-Yb y Ac-No en sus lugares adecuados, y no divididos y colocados debajo de los demás elementos. |
Pero antes de empezar, tengo que darle una guía aproximada de la geografía y el mapa. En la Figura 1 ve usted la tabla periódica en su versión de 2012, escrita en la denominada «forma larga», que resalta el lugar apropiado de los elementos más pesados tales como el uranio (U) y el gadolinio (Gd), algo así como tener un mapa con las islas Orcadas y las islas Shetland en sus posiciones exactas con respecto al territorio principal del Reino Unido y no en los campos de petróleo al este de Aberdeen o Dundee. O a mostrar Alaska y Hawái en la misma cuadrícula que el territorio principal de Estados Unidos y no hacerlos aparecer al sur de California y al oeste de Texas.
Para darle una idea de por qué la dibujamos así permítame llevarle a una imaginaria reserva natural en la sabana africana donde pastan ociosamente dos tipos de cebras, unas con franjas negras y otras con franjas blancas. Hay solo un abrevadero en toda la sabana, de modo que todas las cebras tienen que ir allí al menos una vez al día. El problema es que estas cebras son muy agresivas. Una cebra con franjas blancas solo tolerará a una cebra con franjas negras, y viceversa; más cebras y el resultado será una lucha cruel.
Con solo dos cebras, una de cada tipo, no habrá problemas. Pastarán ociosamente, evitándose todo lo que puedan y siguiendo una pauta circular en la hierba con el abrevadero en el centro. Si queremos que haya más cebras, como probablemente queremos pues son animales hermosos, ellas tendrán que arreglárselas de algún modo para evitar la lucha. Para que puedan hacerlo planeamos vallar la sabana y dividirla en zonas como pedazos de una tarta. Sin embargo, la dirección del parque solo nos permitirá hacerlo de tres diferentes maneras, donde podemos albergar un total de seis, diez y catorce cebras en total en cada conjunto de rediles (véase la Figura 2).
 F IGURA 2. Rediles para mantener separados los dos tipos de cebras pero permitiéndoles acceder al abrevadero central. |
Los electrones se comportan de un modo parecido a estas cebras: son atraídos por el núcleo positivo pero quieren evitarse unos a otros a toda costa, pues cargas iguales se repelen mutuamente. Pueden tolerar un vecino, pero solo si tiene «espín» opuesto, una propiedad responsable de los fenómenos cotidianos del magnetismo pero que en cualquier caso es difícil de precisar. Hay electrones con «espín arriba» y «espín abajo», pero son tan difíciles de distinguir como decir si una cebra tiene franjas negras o franjas blancas. La naturaleza los mantiene apartados y los recluye en grupos de a lo sumo dos, seis, diez o catorce electrones en cada conjunto de rediles (que ahora hay que imaginar como secciones tridimensionales del espacio en torno a cada núcleo), que llamamos orbitales y utilizamos las letras s, p, d y f para referirnos a ellos.
A medida que añadimos protones a los núcleos para formar elementos más pesados también añadimos electrones, y estos tienen que terminar en uno de los recintos s, p, d o f , y una vez que hemos empezado a llenar un redil continuaremos hasta que esté completo. La pregunta es: ¿cuántos y en qué orden se llenan? Garabateemos los números en una hoja de papel a la manera de Dan Brown para formar una figura, tal como se ve en la Figura 3.
A continuación dibujamos una línea diagonal en zigzag a través de los números, y esta trazará un camino a través de la tabla periódica en orden de número atómico creciente, es decir, H, He, Li, Be, B y así sucesivamente. Si luego reemplazamos, sobre la marcha, cada símbolo de elemento por el número máximo de electrones en el orbital concreto que estamos llenando, obtendremos la imagen de la Figura 4. Ahora es evidente, espero, que la geografía de la tabla periódica pueda describirse de forma aproximada como algo que tiene cuatro «continentes», los de los 2, 6, 10 o 14 electrones en el último tipo de recinto llenado, o como preferimos decir, los de los s-, p-, d- y f -elementos.
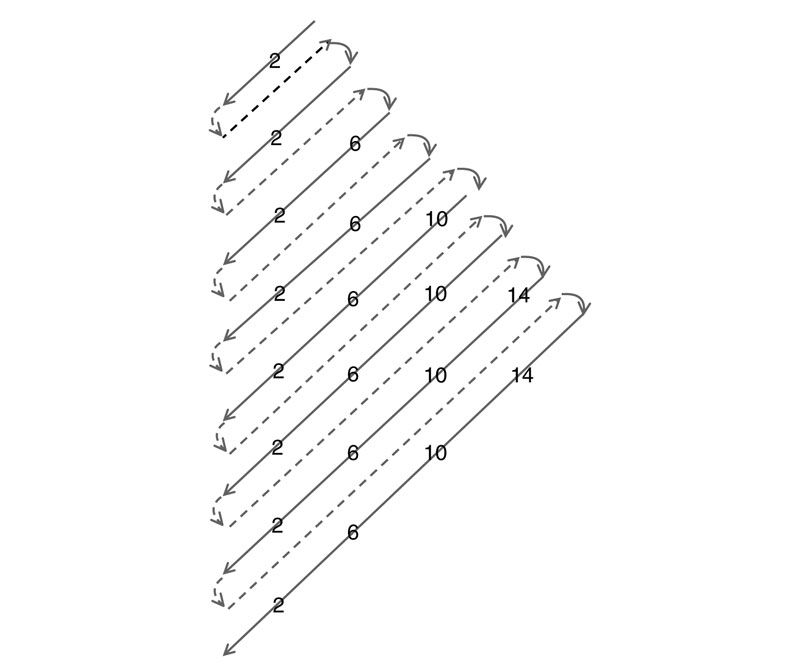 F IGURA 3. Encontrando una pauta de vallado para los electrones: cada redil, u orbital, tendrá un máximo de 2, 6, 10 o 14 electrones. La línea que corta los números a la derecha traza una ruta a través de la tabla periódica. |
Los químicos no se ocuparían en este ejercicio de numerología si el mapa que produce no les ayudara a maniobrar entre los átomos y las moléculas en el mundo real, pero el hecho es que lo hace. Distinguir elementos por el tipo de orbital último en llenar s, p, d o f es muy útil y un primer paso para comprender la química de los elementos.
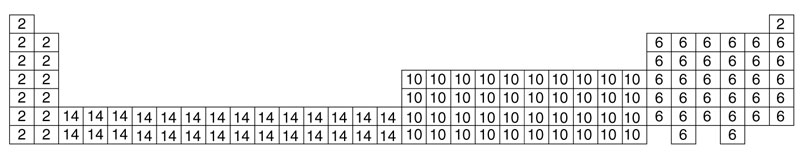 F IGURA 4. Tabla periódica que muestra los cuatro «continentes», los de a lo sumo 2, 6, 10 o 14 electrones en el último orbital lleno. También les llamamos elementos s, p, d y f , respectivamente. |
Una y otra vez los químicos reordenan la tabla periódica en forma espiral, edificios tridimensionales o en versiones circulares o cilíndricas. Los aficionados a la tabla periódica afirman que hay al menos setecientas variantes,
Cabría imaginar a Dan Brown haciendo que su profesor de «simbología» Robert Langdon sino molibdeno?